INFORME FINAL
Universidad Nacional Abierta y a Distancia

Presentado por: Danna Alejandra Rivera Jimenez - Luisa Fernanda Barbosa.
 El pasado siete (7) de Noviembre del presente año asistieron a la institución educativa Ex-alumnas de la Presentación profesionales que hacen parte de la Universidad Nacional Abierta y a Distancia donde realizaron una conferencia sobre la Problemática Ambiental mundial que se vive dando a lo largo de los años, cabe destacar que aún sigue presente y cada vez afecta más de manera directa a las generaciones posteriores.
El pasado siete (7) de Noviembre del presente año asistieron a la institución educativa Ex-alumnas de la Presentación profesionales que hacen parte de la Universidad Nacional Abierta y a Distancia donde realizaron una conferencia sobre la Problemática Ambiental mundial que se vive dando a lo largo de los años, cabe destacar que aún sigue presente y cada vez afecta más de manera directa a las generaciones posteriores.
Problemática Ambiental - Calentamiento Global.
El hombre principalmente para poder vivir necesita de tres elementos importantes e indispensables, los cuales son:
- Agua
- Aire
- Tierra
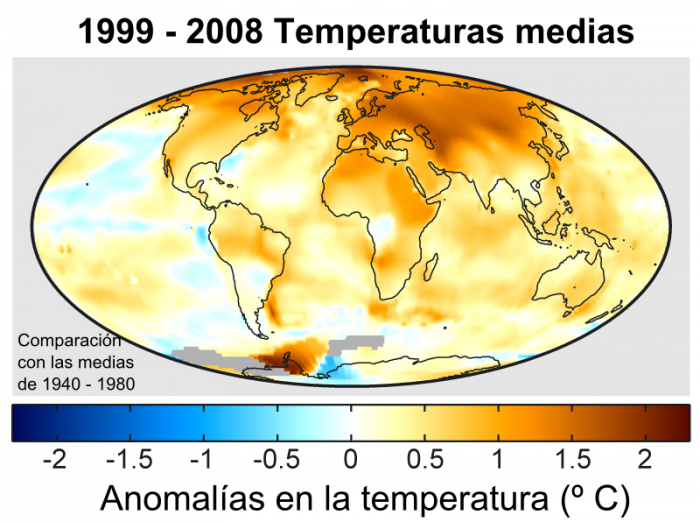
El calentamiento global y cambio climático hace referencia básicamente al aumento observado en más de un siglo de la temperatura del sistema climático de la Tierra y sus efectos. Múltiples líneas de pruebas científicas demuestran que el sistema climático se está calentando. Muchos de los cambios observados desde los años 1950 no tienen precedentes en el registro instrumental de temperaturas que se extiende a mediados del siglo XIX.
SUS ORÍGENES:
 Las causas naturales: se atribuyen principalmente a la liberación natural de gas de metano en diferentes partes del planeta, especialmente en la tundra ártica y en los pantanos. Este gas provoca lo que se conoce como efecto invernadero, un proceso que resulta en la concentración del calor tras ser atrapado en la atmósfera.
Las causas naturales: se atribuyen principalmente a la liberación natural de gas de metano en diferentes partes del planeta, especialmente en la tundra ártica y en los pantanos. Este gas provoca lo que se conoce como efecto invernadero, un proceso que resulta en la concentración del calor tras ser atrapado en la atmósfera.
Las causas humanas: de este fenómeno, los principales responsables son el desarrollo industrial y las actividades necesarias para mantener el estilo de vida consumista propio de nuestro sistema capitalista.
→La minería.
→La de forestación.
→Las poluciones generadas.
→Enormes cantidades de dióxido de carbono.
El aumento de la temperatura global resultará en cambios como ya se están observando a nivel mundial, podemos enumerar:
1. Aumento de los niveles del mar
2. Cambios en el patrón y cantidad de precipitaciones
3. Expansión de los desiertos sub-tropicales
➜También el vapor de agua es una fuente importante de aumento de la temperatura, pero también de la formación de las nubes y las precipitaciones. Es un proceso de retro-alimentación natural que funciona como un equilibrio.
➜El dióxido de carbono se libera a través de la respiración y los eventos volcánicos, gas también considerado de efecto invernadero, pero sus cantidades son suficientes para que se mantenga una temperatura estable en el planeta.
➜Otra causa natural son los ciclos climáticos que atraviesa la Tierra regularmente. Estos a su vez han estado determinados por las fluctuaciones solares.
➜Si la energía del Sol es la fuente que impulsa nuestro clima, es natural que su radiación tenga un papel en los cambios de temperatura de la Tierra.
CONSECUENCIAS:

Otras consecuencias que deberías tener en cuenta:
➤Temperaturas más cálidas.
La acumulación de gases contaminantes hace que las temperaturas aumenten cada vez más y que los climas cambien: esto provoca sequías y, además, aumenta el riesgo de incendios que conllevan la deforestación y la desertización del planeta.
➤Tormentas más intensas.
El hecho de que las temperaturas sean más altas hace que las lluvias sean menos frecuentes, pero que sean más intensas; por tanto, el nivel de inundaciones y su gravedad también irán en aumento.
➤Propagación de enfermedades.
Un cambio de temperatura de varios grados puede hacer que la zona templada se haga más acogedora a la propagación de determinadas enfermedades. De esta manera, pueden empezar a darse casos de mal de Chagas, el dengue u otras enfermedades que están olvidadas en los países desarrollados y en zonas que tradicionalmente han sido más frías.
➤Olas de calor más fuerte.
 El calentamiento global del planeta producido por la quema acelerada de combustibles fósiles agotables ha sido muy intenso en el Polo Norte. Esto hace que el Polo Norte esté hoy mucho más caliente que hace cincuenta años.
El calentamiento global del planeta producido por la quema acelerada de combustibles fósiles agotables ha sido muy intenso en el Polo Norte. Esto hace que el Polo Norte esté hoy mucho más caliente que hace cincuenta años.➤Derretimiento de los glaciares.
Océanos con temperaturas más altas son océanos que derriten el hielo de los casquetes polares: esto significa que aumenta el nivel del mar.
➤Huracanes más peligrosos.
➤Cambio de los ecosistemas.
Una temperatura más alta, menos precipitaciones, sequías e inundaciones hacen que el clima se adapte a esta nueva climatología y, por tanto, se produzcan cambios en la duración de las estaciones, aparezcan patrones más propios de climas monzónicos.
➤Desaparición de especies animales.
Muchas especies de animales están viendo cómo su clima actual desaparece y no son capaces de adaptarse a cambios tan rápidamente.
➤Aumento del nivel del mar.
Como los casquetes se derriten, se vierte muchísima más agua en los mares y océanos y, por tanto, aumenta el nivel del mar: esta es una de las consecuencias del cambio climático más graves, ya que significa que muchísimas islas podrían desaparecer en el futuro y que un buen número de ciudades verán cómo su distancia a la costa se reduce de forma significativa.
➤Alimentos más costosos.
El cambio climático pone en peligro la producción de alimentos tan básicos como el trigo, y esto significa que cientos de miles de personas cuya vida depende de sus cultivos están en riesgo de perderlo todo.


- Reemplaza las lámparas incandescentes regulares con lámparas fluorescentes compactas (lfc)
- Utiliza menos agua caliente
- Apaga los equipos electrónicos que no estés usando
- Desconecta los equipos electrónicos de los contactos cuando no los utilices
- Asegúrate de reciclar en casa
- Planta un árbol
- Compra alimentos orgánicos lo más posible.
- Comparte tu vehículo con tus compañeros de trabajo o de clases.
- A la hora de comprar un vehículo nuevo, elige uno con consumo más eficiente de combustible
- Fomenta en tu escuela o empresa la reducción de emisiones
- Fomenta el cambio hacia energías renovables
- Protege y conserva los bosques del planeta
- Haz que tu voz sea escuchada.

POEMA:
Si el planeta quieres salvar
tus hábitos tendrás que cambiar
empezando por caminar
y a diario la bici utilizar.
Utilices nuestra voz
para hacer conciencia
y crear revolución
para que el mundo logre su salvación.
En tus manos quedará
la bio-diversidad rescatar
desde el hogar puedes empezar
a sembrar, cuidar y reciclar.
¡NO TE DEJES ENGAÑAR
DE TI DEPENDE VIVIR MÁS!
VÍDEOS: