BALANCEO DE ECUACIONES QUÍMICAS
INTRODUCCIÓN
Buen día usuarios de mi blog, les doy de nuevo la bienvenida al sitio donde podrán encontrar un excelente aliado a la hora de aprender la química de 10°. por medio de esta entrada, estudiaremos a fondo algunos métodos para balancear ecuaciones químicas, proceso que más adelante se convertirá en algo esencial para el desarrollo de los temas siguientes. Espero serles de gran ayuda.
OBJETIVOS
OBJETIVOS
- Aprender diferenciarlos diversos métodos existentes par el balanceo de ecuaciones químicas, en este caso, el método de tanteo y oxido-reducción.
- Ser una útil herramienta a la hora de comprender procesos químicos de balanceo.
- Aprender algunas reglas de asignación de números de oxidación, proceso necesario para antes de balancear
MARCO TEÓRICO
El objetivo de balancear una ecuación química es hacer que cumpla con la Ley de la conservación de la masa la cual establece que en una reacción química la masa de los reactivos debe ser igual a la masa de los productos.
.
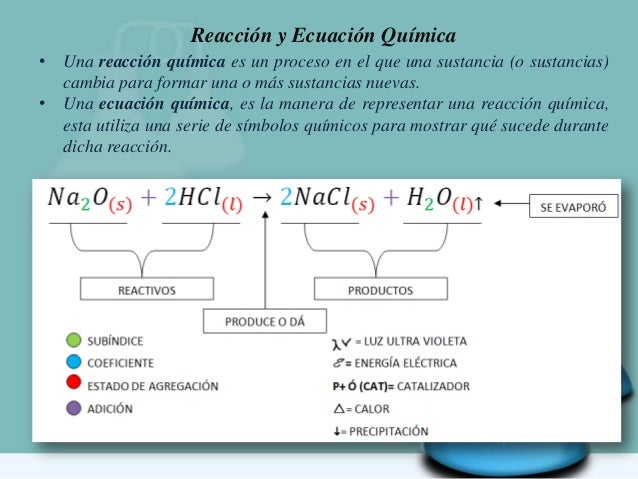
Para equilibrar o balancear ecuaciones químicas, existen diversos métodos. La ecuación química equilibrada describe exactamente las cantidades de los reactantes y productos en una reacción química. La ley sobre la conservación de la masa dice que en la reacción química la masa no se puede ni producir ni destruir. Esto significa que la ecuación química debe tener por ambos lados el mismo número de átomos de cada elemento. Para que una ecuación esté equilibrada, las sumas de las cargas eléctricas en ambos lados tienen que ser idénticas.. Estudiaremos a fondo los métodos de tanteo y oxido-reducción
BALANCEO DE ECUACIONES QUÍMICAS POR TANTEO
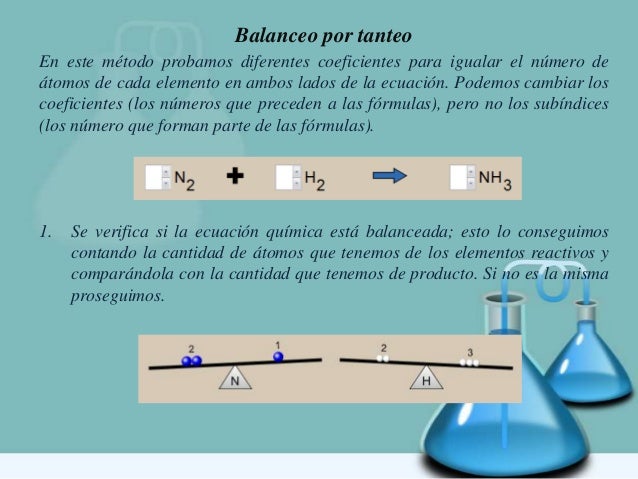
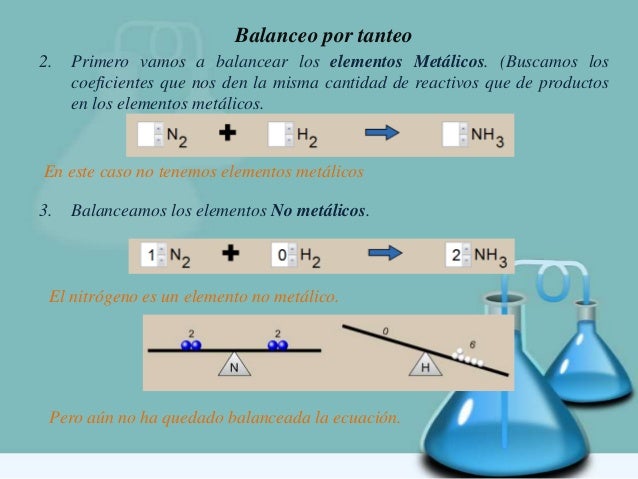
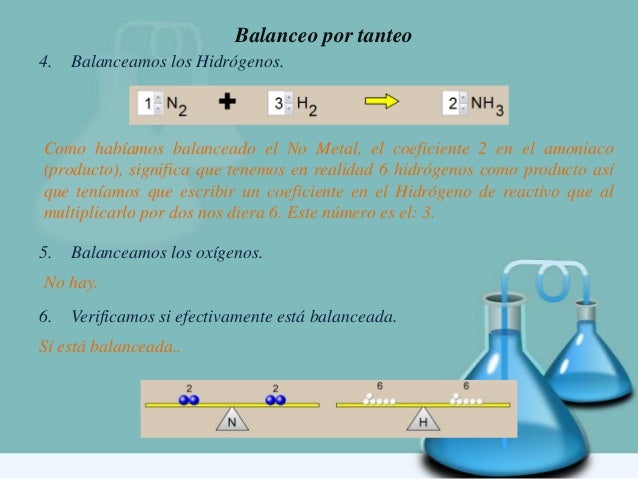
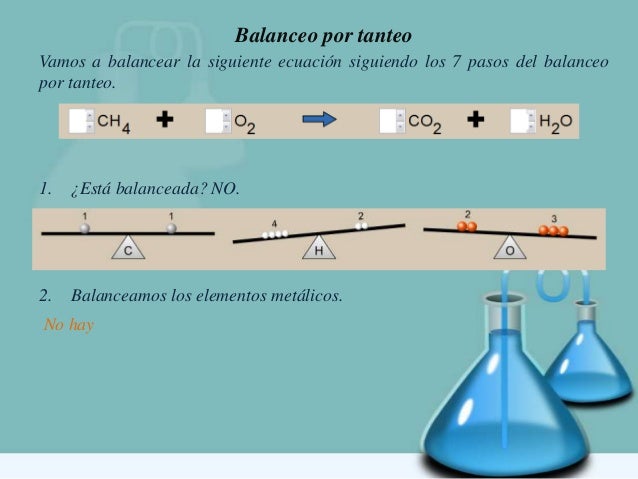
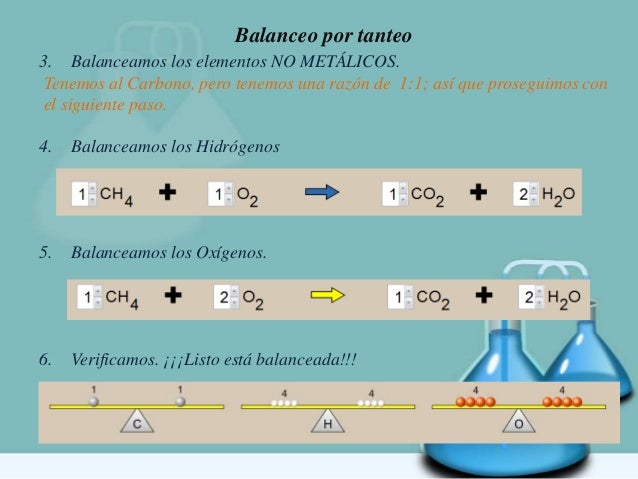
Ejemplo: Balancear la siguiente ecuación
H2O + N2O5 NHO3
Aquí apreciamos que existen 2 Hidrógenos en el primer miembro (H2O). Para ello, con solo agregar un 2 al NHO3 queda balanceado el Hidrogeno.
H2O + N2O5 2 NHO3
Para el Nitrógeno, también queda equilibrado, pues tenemos dos Nitrógenos en el primer miembro (N2O5) y dos Nitrógenos en el segundo miembro (2 NHO3)
Para el Oxigeno en el agua (H2O) y 5 Oxígenos en el anhídrido nítrico (N2O5) nos dan un total de seis Oxígenos. Igual que (2 NHO3)
BALANCEO DE ECUACIONES QUÍMICAS POR REDOX
Es también denominado "Redox" y consiste en que un elemento se oxida y (hablar de oxidación se refiere a que un elemento pierda electrones y su valencia aumente) el otro se reduce (cuando el elemento gana electrones y su valencia disminuye) para éste método se siguen los siguientes pasos o reglas:
- 1. Todos los elementos libres que no formen compuesto, tendrán valencia cero
- 2. El hidrógeno tendrá valencia de +1 excepto en hidruros con -1
- 3. El oxígeno tendrá valencia de 2- excepto en los peróxidos con -1
- 4. Los alcalinos tienen en sus compuestos oxidación +1
- 5. Los alcalinotérreos tienen en sus compuestos oxidación +2
- 6. Los alógenos tienen en sus compuestos con aluros oxidación -1
- 7. La suma de los números de oxidación de todos los átomos de un compuesto es igual a la carga de los compuestos
- 8. Si algún átomo se oxida su numero de oxidación aumenta y cuando un átomo se reduce, su numero de oxidación disminuye

Ejemplo:
Balancear la siguiente ecuación:
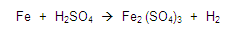
Si vemos la primera regla, esta nos dice que todos los elementos libres tendrán valencia cero, entonces vemos la ecuación y localizamos a los elementos libres, en este caso son el fierro y el hidrógeno, colocamos un cero como valencia.
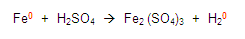
Continuamos con las demás reglas y encontramos a los oxígenos e hidrógenos y les asignamos la valencia que les corresponde, establecidas en las reglas:
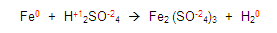
Para continuar, obtenemos la valencia de los elementos que nos sobran, en este caso el azufre y el fierro:
Ubiquémonos en el azufre (S) del primer miembro en la ecuación
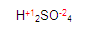
y posteriormente obtendremos la valencia del azufre. Quede claro que la del hidrógeno y la del oxígeno ya la tenemos.
Para obtener la valencia del azufre, simplemente (pon mucha atención aquí) vamos a multiplicar la valencia del oxígeno por el número de oxígenos que hay. (En este caso hay 4 oxígenos) y hacemos lo mismo con el hidrógeno, multiplicamos su valencia por el número de oxígenos que hay. Queda de la siguiente manera
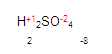
Ya que tenemos los resultados, ahora verificamos que todo elemento químico es eléctricamente neutro y lo comprobamos de la siguiente manera:
Tenemos que llegar a cero. Buscamos cuanto falta de dos para ocho. Entonces encontramos que faltan 6, este número será colocado con signo positivo +
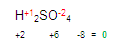
El 6 que acabamos de obtener es la valencia del azufre en el primer miembro.
Ubiquémonos en el fierro del segundo miembro en donde se encuentra el compuesto
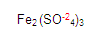
Localizamos al fierro. Para obtener su valencia primero denominamos si es monovalente o divalente etc. Ya que vimos que es divalente, necesitamos saber la valencia del radical sulfato, en este caso es
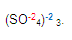
Para obtener la valencia del fierro, multiplicamos la valencia del radical (-2) con el subíndice que se encuentre fuera del mismo
Después lo dividimos entre el número de fierros que hay en el compuesto (en este caso hay dos fierros)
Queda de la siguiente manera:
2 * 3 = 6 6/2 = 3
El tres que acabamos de obtener es la valencia del fierro.
Que nos quede claro, ya tenemos la valencia del fierro que es 3, ya tenemos la valencia del oxígeno que es -2, ahora nos falta la valencia del azufre (S) lo cual realizaremos algo similar con lo dicho con anterioridad:
Multiplicamos la valencia del radical sulfato (-2) con el subíndice (3) y después con el número de oxígenos que hay dentro del paréntesis (4).

Obtenemos un total de 24. Este número que resultó se le llama valencia parcial
Después continuamos con el fierro. Ahora ya que tenemos que la valencia del fierro es 3 entonces multiplicamos la valencia por el numero de fierros que hay (hay 2)
Y nos da un resultado de 6.
Entonces:
Tenemos 6 y tenemos -24, de 6 a 24 ¿Cuánto falta?
Respuesta: +18
Ahora el 18 lo dividimos entre el número de azufres que hay: nos da un total de 6 o sea +6.
Y de esta manera ya obtuvimos todas las valencias del compuesto químico:
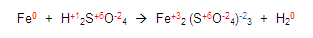
Ahora, vamos a verificar cuál elemento se oxida y cual se reduce, para esto, chequemos las valencias de los elementos, debemos verificar que en los dos miembros estén iguales.
Si vemos al fierro en el primer miembro y luego lo vemos en el segundo. Encontramos que sus valencias ya no son las mismas por tanto el elemento se está oxidando porque aumenta su valencia de cero a 3
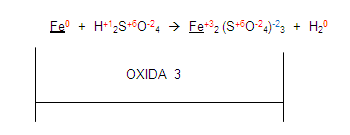
Ahora, si nos fijamos en el hidrógeno del primer miembro, se está reduciendo con el hidrógeno del segundo miembro:
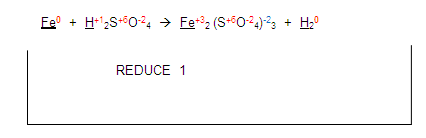
Entonces la ecuación queda de la siguiente manera:
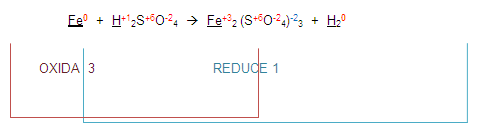
Ahora, para poder completar el balanceo, (atención) vamos a intercambiar los números que se oxidaron o redujeron. Esto es el 3 y el 1.
El 3 lo colocaremos en el lugar del 1 y el 1 en el lugar del 3
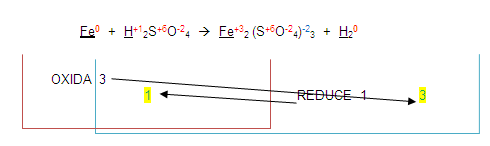
Estos números resultantes se colocan de lado izquierdo de los elementos que se oxidaron o redujeron.
El número 1 (que por lo general no se escribe) se coloca de lado izquierdo del fierro en los dos miembros.
El número 3 se coloca de lado izquierdo del hidrógeno en los dos miembros quedando de la siguiente forma:
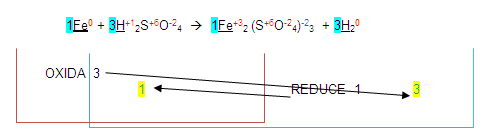
Entonces de esta manera podemos deducir que la ecuación está balanceada, pero, no es así, uno de los pasos para terminarla es: "Una vez obtenidos los números de la ecuación, se completará con método de tanteo".
Verificamos si así está balanceada:
1= Fe =2
3= S =3
12= O =12
6= H =6
Con este insignificante 2 que acabos de encontrar en el fierro del segundo miembro LA ECUACIÓN NO ESTÁ BALANCEADA aunque los demás átomos lo estén.
Completamos por tanteo
En el primer miembro (Fe) hay 1 átomo, en el segundo 2, entonces colocamos un 2 en el primer miembro y…
YA ESTÁ BALANCEADA.
Con esto finalizamos el método de REDOX
 En otro caso, el peróxido de hidrógeno reacciona con el cloruro de zinc(I), produciendo agua y cloruro de zinc(II). ¿Cuáles son los coeficientes de cada fórmula?
En otro caso, el peróxido de hidrógeno reacciona con el cloruro de zinc(I), produciendo agua y cloruro de zinc(II). ¿Cuáles son los coeficientes de cada fórmula?
-
- La ecuación es H2O2 + ZnCl → H2O + ZnCl2
- Rápidamente se observa que el NO del oxígeno pasa de -1 (¡es un peróxido!) a -2, mientras que el zinc cambia de +1 a +2 (esto se sabe porque ambas sales presentan estos iones). Ni el hidrógeno ni el cloro sufren variación.
- Advertimos que el NO del O se hace más negativo, (se reduce) y el NO del Zn se hace más positivo, (pierde electrones, se oxida). Así pues, escribimos:
-
- H2O2-1 → H2O-2 y se escribe la molécula entera porque son sustancias covalentes
- (Zn+1)+ → (Zn+2)++
-
-
- 3er. paso:
-
- H2O2-1 → 2 H2O-2
- (Zn+1)+ → (Zn+2)++
-
- 4º paso
-
- H2O2-1 + 2 e- → 2 H2O-2 ¡porque en el peróxido hay dos O, y cada uno gana un electrón!.............REDUCCIÓN
- (Zn+1)+ → (Zn+2)++ + 1 e-..........................................................OXIDACIÓN
-
- 5º paso. Como no se indica la acidez del medio, tomaremos medio ácido:
-
- H2O2-1 + 2 e- + 2 H+ → 2 H2O-2
- (Zn+1)+ → (Zn+2)++ + 1 e- ; está equilibrada
-
- 6º paso:
-
- Como el número de H está igualado, podemos saltarnos el 6º paso.
-
- 7º paso:
-
- Multiplicamos por 2 el proceso de oxidación y sumamos, con lo cual el número de electrones se anula (por estar en distinto miembro algebraico) y nos queda...
- H2O2 + 2 H+ + 2 (Zn)+ → 2 H2O + 2 (Zn)++
-
- 8º paso:
-
- Los coeficientes obtenidos se trasladan al proceso general:
-
-
- H2O2 + 2 ZnCl + 2 H+ → 2 H2O + 2 ZnCl2
-
-
- Los coeficientes obtenidos se trasladan al proceso general:
-
- 3er. paso:
- Existe una anomalía en el número de cloros. Se puede suponer que realmente los iones H+ han sido suministrados por dos moléculas de HCl, con lo que todo queda correcto:
-
-
-
-
-
- H2O2 + 2 ZnCl + 2 HCl → 2 H2O + 2 ZnCl2
-
-
-
-
-
Un ejemplo más: Cuando el sulfito potásico reacciona con permanganato potásico (en medio alcalino) se produce sulfato potásico y bióxido de manganeso. Balancear la ecuación química correspondiente.
-
- El proceso es... K2SO3 + KMnO4 → K2SO4 + MnO2
Y después de estudiar la ecuación decidimos escribirla de esta forma:
-
-
-
-
- (SO3)= + (MnO4)- → (SO4)= + MnO2
-
-
-
ya que el ión potásico no cambia su NO y además el MnO2 es covalente.
-
-
- Calculamos los NO...
-
- El azufre S pasa de +4 a +6 y el manganeso Mn pasa de +7 a +4. Y esto se expresa así:
- (S+4O3)= → (S+6O4)=
- (Mn+7O4)- → Mn+4O2
- Como los átomos de S y de Mn están igulados, pasaremos a ajustar los cambios de NO:
- (S+4O3)= → (S+6O4)= + 2 e-...............................OXIDACION
- (Mn+7O4)- + 3 e- → Mn+4O2....................REDUCCION
- Podemos decir que los iones sulfito (¡en medio básico!) reducen al permanganato (ó que el permanganato oxida a los sulfitos)
- El azufre S pasa de +4 a +6 y el manganeso Mn pasa de +7 a +4. Y esto se expresa así:
-
- Ajustamos las cargas eléctricas (¡en medio básico!)...
-
-
- (SO3)= + 2 (OH)- → (SO4)= + 2 e-
- (MnO4)- + 3 e- → MnO2 + 4 (OH)-
-
-
- Bueno, ya estamos terminando; equilibramos la cantidad de H...
-
-
- (SO3)= + 2 (OH)- → (SO4)= + 2 e- + H2O
- (MnO4)- + 3 e- + 2 H2O → MnO2 + 4 (OH)-
-
-
- Y ahora, para sumar y simplificar, multiplicamos la semirreacción superior por 3 y la de abajo por 2:
-
-
- 3 (SO3)= + 6 (OH)- → 3 (SO4)= + 6 e- + 3 H2O
- 2 (MnO4)- + 6 e- + 4 H2O → 2 MnO2 + 8 (OH)-
-
-
- Con todo lo cual se queda así:
-
-
- 3 (SO3)= + 2 (MnO4)- + H2O → 3 (SO4)= + 2 MnO2 + 2 (OH)-
-
-
- La ecuación ya está balanceada, pero puede interesarnos escribirla de este modo:
-
-
- 3 SO3K2 + 2 MnO4K + H2O → 3 SO4K2 + 2 MnO2 + 2 (OH)-
-
-
- y observamos que hay una disparidad en el número de K. Bien, podemos pensar que la base utilizada ha sido hidróxido potásico, pero que aparece en el 2º miembro de la ecuación:
-
-
- 3 SO3K2 + 2 MnO4K + H2O → 3 SO4K2 + 2 MnO2 + 2 K(OH)
-
-
- Calculamos los NO...
-
Para terminar, proponemos el ajuste de estas ecuaciones redox:
-
-
-
-
-
-
- (Cr2O7)= + I- +H+ → Cr+++ + I2
- HCl + SnCl2 + H2O2 → SnCl4 + H2
-
-
-
-
-
CONOCIMIENTOS EN PRÁCTICA
ACTIVIDAD EN LÍNEA




























