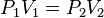GASES.
LABORATORIO DE GASES.
En esta oportunidad hablaremos sobre todo lo relacionado con gases, como por ejemplo su definición, propiedades, características y leyes que la rigen, además de esto también realizaremos un laboratorio en el cual podremos observar y practicar sus diversas aplicaciones donde se introduce los diversos conocimientos que ya hemos analizado y comprendido. Como lo veremos más adelante en la experimentación que se va a desarrollar nos daremos cuenta que los gases son fluidos altamente comprensibles y por ende se ven con frecuencia grandes cambios. Sera una forma didáctica y sencilla de introducirse en estos temas tan variados.
OBJETIVOS:
- Comprender y saber diferenciar sobe los conceptos de gases.
- Hablar sobre las Leyes y aprender de ellas,
- Saber en que momento y en que circunstancias se debe utilizar cada ley.
- Analizar y desarrollar los ejercicios estipulados para así tener más claros estás leyes.
- Emplear principios matemáticos básicos, como por ejemplo despejar ecuaciones.
- Diferenciar las formulas de cada Ley.
- Utilizar correctamente la calculadora.
- Reforzar algunos temas ya vistos.
MARCO TEÓRICO.
Se denomina gas al estado de agregación de la materia en el que las sustancias no tienen forma ni volumen propio, adoptando el de los recipientes que las contienen. Las moléculas que constituyen un gas casi no son atraídas unas por otras, por lo que se mueven en el vacío a gran velocidad y muy separadas unas de otras, explicando así las propiedades:
¿Cuales son las propiedad de un gas?
1. Las moléculas de un gas se encuentran prácticamente libres, de modo que son capaces de distribuirse por todo el espacio en el cual son contenidos. Las fuerzas gravitatorias y de atracción entre las moléculas son despreciables, en comparación con la velocidad a que se mueven las moléculas.
1. Las moléculas de un gas se encuentran prácticamente libres, de modo que son capaces de distribuirse por todo el espacio en el cual son contenidos. Las fuerzas gravitatorias y de atracción entre las moléculas son despreciables, en comparación con la velocidad a que se mueven las moléculas.
2. Los gases ocupan completamente el volumen del recipiente que los contiene.
3. Los gases no tienen forma definida, adoptando la de los recipientes que las contiene.
4. Pueden comprimirse fácilmente, debido a que existen enormes espacios vacíos entre unas moléculas y otras.
Definiciones que debes tener en cuenta:
Existen diversas leyes que relacionan la presión, el volumen y la temperatura de un gas.
Existen diversas leyes que relacionan la presión, el volumen y la temperatura de un gas.
LA MATERIA.
¿Cuales son sus estados de agregación?
Estados de la materia:
Esta escala divide el rango entre las temperaturas de congelación y de ebullición del agua en 100 partes iguales. Usted encontrará a veces esta escala identificada como escala centígrada. Las temperaturas en la escala Celsius son conocidas como grados Celsius (ºC).
Escala Fahrenheit
Esta escala divide la diferencia entre los puntos de fusión y de ebullición del agua en 180 intervalos iguales. Las temperaturas en la escala Fahrenheit son conocidas como grados Fahrenheit (ºF).
Escala de Kelvin
Prolonga la escala Celsius hasta el cero absoluto, una temperatura hipotética caracterizada por una ausencia completa de energía calórica. Las temperaturas en esta escala son llamadas Kelvins (K).
¿Como convertir temperaturas?
K= °C + 273 (Grados Celsius a grados Kelvin)
°F= 9/5 °C + 32 (Grados Centígrados a grados Fahrenheit)
°C= 5/9 °F - 32 (Grados Fahrenheit a grados Celsius)
°C= 5/9 °F - 32 (Grados Fahrenheit a grados Celsius)
Comparación entre Temperaturas
A continuación encontrará algunas comparaciones comunes entre temperaturas de las escalas Celsius y Fahrenheit.
TEMPERATURA | ºC | ºF |
Punto Ebullición Agua | 100 | 212 |
Punto Congelación Agua | 0 | 32 |
Temperatura Corporal Promedio del Cuerpo Humano | 37 | 98.6 |
| Temperatura ambiente confortable | 20 to 25 | 68 to 77 |
Tú probablemente haces referencia a la temperatura todos los días. Asegúrate de estar usando la escala correcta.
Presión.
Es la medida del efecto de la distribución de fuerzas normales (perpendiculares) aplicada sobre una superficie o área.
Se le llama Presión, a la reacción inmediata que ejerce un cuerpo sobre otro en relación de peso o fuerza. La presión técnicamente se refiere a dos tipos fundamentales, opresión y compresión, la opresión es comúnmente asociada a la falta de libertad de un sujeto para movilizarse con plena independencia, y la compresión se refiere al esfuerzo o impedimento que realiza un cuerpo sobre otro impidiendo su salida de algún sitio.
la presión de cierto vapor o gas puede provocar la ruptura de algún reactor, asi como también en algún instrumento de medición puede arrojar datos relevantes de cualquier estudio. La presión es básicamente usada para determinar procesos en los que la temperatura juega un papel fundamental en la realización de algún experimento con una reacción química.
Efecto de la presión en el volumen de un gas:
Propiedades de la presión:
1. La presión en todos los puntos situados en un mismo plano horizontal en el seno de un fluido en reposo (y situado en un campo gravitatorio constante) es la misma.
2.La fuerza asociada a la presión en un fluido ordinario en reposo se dirige siempre hacia el exterior del fluido, por lo que debido al principio de acción reacción, resulta en una compresión para el fluido, jamás una tracción.
3.La superficie libre de un líquido en reposo (y situado en un campo gravitatorio constante) es siempre horizontal. Eso es cierto sólo en la superficie de la Tierra y a simple vista, debido a la acción de la gravedad no es constante. Si no hay acciones gravitatorias, la superficie de un fluido es esférica y, por tanto, no horizontal.
4.En los fluidos en reposo, un punto cualquiera de una masa líquida está sometida a una presión que es función únicamente de la profundidad a la que se encuentra el punto. Otro punto a la misma profundidad, tendrá la misma presión. A la superficie imaginaria que pasa por ambos puntos se llama superficie equipotencial de presión o superficie isobárica.
1. barómetro
2. manómetro
3. tubo de Pitot (utilizado para determinar la velocidad)
4. piezometro
Volumen.
El volumen corresponde a la medida del espacio que ocupa un cuerpo. La unidad de medida para medir volumen es el metro cubico (m3), sin embargo generalmente se utiliza el Litro (L).
El metro cubico corresponde a medir las dimensiones de un cubo que mide 1 m de largo, 1 m de ancho y 1 m de alto.
La temperatura influye directamente sobre el volumen de los gases y los líquidos
- Si la temperatura aumenta, los sólidos y los líquidos se dilatan.
- Si la temperatura disminuye, los sólidos y los líquidos se contraen.
Medición de Volumen
Existen variadas formas de medir volúmenes.
- Para medir el volumen de un líquido se pueden utilizar instrumentos como un vaso precipitado, probeta, pipeta, matraces, entre otros.
- Para medir el volumen de un sólido irregular, se puede utilizar el método por inmersión en agua. Así el volumen del solido será la diferencia entre el volumen final, que se mide cuando el objeto está dentro de una probeta, menos el volumen inicial.
- Para medir el volumen de un sólido geométrico se suelen utilizar formulas matemáticas. Por ejemplo para medir el volumen de una esfera, un cubo, o un cilindro se utilizan las siguientes formulas.

Cantidad de gas.
- Leyes de los gases.
Avogadro:
Amedeo Avogadro fue un físico italiano que a través de la hipótesis sobre el número de moléculas existentes en estas muestras de gas, explicó como los gases se combinan, manteniendo una proporción simple entre ellos y aún concluye que el hidrógeno, el oxígeno y el nitrógeno se encuentran en la forma biatómica, o sea: H2, O2 y N2.
Pero no fue sino hasta que el científico Avogadro, se apoyó en los conocimientos preexistentes de su época sobre los gases y en los resultados de sus experimentos, que se formuló una hipótesis sobre el número de moléculas que existen en dos muestras de gas.
 Esta suposición dice que dos recipientes, del mismo volumen, conteniendo gases diferentes, a la misma temperatura y presión, deberían contener el mismo número de moléculas.
Esta suposición dice que dos recipientes, del mismo volumen, conteniendo gases diferentes, a la misma temperatura y presión, deberían contener el mismo número de moléculas.
Años más tarde, el profesor de físico-química Jean Baptiste Perrin, realizó varios experimentos con el fin de determinar el valor del número de avogadro, o sea, la cantidad de moléculas existentes en un mol de sustancia.
Con sus estudios, llegó a un valor comprendido entre 6,5 x 1023 y 7,2 x 1023 moléculas en cada mol y con esto, se ganó el Premio Nobel de Física en el año de 1926.
Después de ese acontecimiento, nuevas experiencas fueron realizadas y por fin, se demostró que es Número de Avogadro es igual a 6,02 x 1023 moléculas por mol de sustancia.
Tomando en cuenta el número de Avogadro, sabemos que hay aproximadamente 6,02 x 1023 átomos/mol.
La ley de Avogadro dice que:
Volúmenes iguales de distintas sustancias gaseosas, medidos en las mismas condiciones de presión y temperatura, contienen el mismo número de moléculas.
El valor de este número, llamado número de Avogadro es aproximadamente 6,022 × 1023 y es también el número de átomos que contiene un mol de un elemento.
Boyle.
La Ley de Boyle-Mariotte (o Ley de Boyle), formulada por Robert Boyle y Edme Mariotte, es una de las leyes de los gases ideales que relaciona el volumen y la presión de una cierta cantidad de gas mantenida a temperatura constante. La ley dice que el volumen es inversamente proporcional a la presión: 

donde  es constante si la temperatura y la masa del gas permanecen constantes.
es constante si la temperatura y la masa del gas permanecen constantes.
 es constante si la temperatura y la masa del gas permanecen constantes.
es constante si la temperatura y la masa del gas permanecen constantes.
Cuando aumenta la presión, el volumen disminuye, mientras que si la presión disminuye el volumen aumenta. El valor exacto de la constante k no es necesario conocerlo para poder hacer uso de la Ley; si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
Además se obtiene despejada que:




Donde:
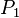 = Presión Inicial
= Presión Inicial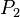 = Presión Final
= Presión Final = Volumen Inicial
= Volumen Inicial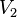 = Volumen Final
= Volumen Final
Esta Ley es una simplificación de la Ley de los gases ideales particularizada para procesos isotermos.
Charles.
La Ley de Charles es una ley de los gases que relaciona el volumen y la temperatura de una cierta cantidad de gas a presión constante.
En 1787 Charles descubrió que el volumen del gas a presión constante es directamente proporcional a su temperatura absoluta (en grados Kelvin): V = k · T (k es una constante).
En 1787 Charles descubrió que el volumen del gas a presión constante es directamente proporcional a su temperatura absoluta (en grados Kelvin): V = k · T (k es una constante).
- Si la temperatura aumenta el volumen aumenta
- Si la temperatura disminuye el volumen disminuye
Gay-Lussac:
La Ley de Gay-Lussac es una ley de los gases que relaciona la presión y la temperatura a volumen constante.
En 1802 Gay-Lussac descubrió que a volumen constante, la presión del gas es directamente proporcional a su temperatura (en grados Kelvin): P = k · T (k es una constante).
En 1802 Gay-Lussac descubrió que a volumen constante, la presión del gas es directamente proporcional a su temperatura (en grados Kelvin): P = k · T (k es una constante).
- Si la temperatura aumenta la presión aumenta
- Si la temperatura disminuye la presión disminuye
Gases ideales.
La ley de los gases ideales es la ecuación de estado del gas ideal, un gas hipotético formado por partículas puntuales sin atracción ni repulsión entre ellas y cuyos choques son perfectamente elásticos (conservación de momento y energía cinética). La energía cinética es directamente proporcional a la temperatura en un gas ideal.
Estos se comportan de forma similar en una amplia variedad de condiciones debido a la buena aproximación que tienen las moléculas que se encuentran más separadas, y hoy en día la ecuación de estado para un gas ideal se deriva de la teoría cinética. Ahora las leyes anteriores de los gases se consideran como casos especiales de la ecuación del gas ideal, con una o más de las variables mantenidas constantes:
P1 V1 / T1 = P2 V2 / T2
Ecuación general de los gases ideales.
Para n (moles) se necesitaría la siguiente formula:
Ley generalizada.
 La ley combinada de los gases o ley general de los gases es una ley de los gases que combina la ley de Boyle, la ley de Charles y la ley de Gay-Lussac. Estas leyes matemáticamente se refieren a cada una de las variables termodinámicas con relación a otra mientras todo lo demás se mantiene constante. La ley de Charles establece que el volumen y la temperatura son directamente proporcionales entre sí, siempre y cuando la presión se mantenga constante. La ley de Boyle afirma que la presión y el volumen son inversamente proporcionales entre sí a temperatura constante. Finalmente, la ley de Gay-Lussac introduce una proporcionalidad directa entre la temperatura y la presión, siempre y cuando se encuentre a un volumen constante. La interdependencia de estas variables se muestra en la ley de los gases combinados, que establece claramente que:
La ley combinada de los gases o ley general de los gases es una ley de los gases que combina la ley de Boyle, la ley de Charles y la ley de Gay-Lussac. Estas leyes matemáticamente se refieren a cada una de las variables termodinámicas con relación a otra mientras todo lo demás se mantiene constante. La ley de Charles establece que el volumen y la temperatura son directamente proporcionales entre sí, siempre y cuando la presión se mantenga constante. La ley de Boyle afirma que la presión y el volumen son inversamente proporcionales entre sí a temperatura constante. Finalmente, la ley de Gay-Lussac introduce una proporcionalidad directa entre la temperatura y la presión, siempre y cuando se encuentre a un volumen constante. La interdependencia de estas variables se muestra en la ley de los gases combinados, que establece claramente que:
La relación entre el producto presión-volumen y la temperatura de un sistema permanece constante.
Donde:
- P es la presión
- V es el volumen
- T es la temperatura absoluta (en kelvins)
- K es una constante (con unidades de energía dividido por la temperatura) que dependerá de la cantidad de gas considerado.
PANTALLAZOS LABORATORIO: